In diesem einfachen physikalischen Versuch kann man selbst ein galvanisches Element bauen. Es wird dazu lediglich ein Stück Blech aus einem edlen und einem unedlen Metall benötigt und natürlich ein Stück Obst. Bei einer sogenannten galvanische Zelle bzw. einem galvanisches Element wird chemische in elektrische Energie umgewandelt. Ein fertiges Set für dieses Physik-Experiment können Sie zum Beispiel hier kaufen.
In diesem einfachen physikalischen Versuch kann man selbst ein galvanisches Element bauen. Es wird dazu lediglich ein Stück Blech aus einem edlen und einem unedlen Metall benötigt und natürlich ein Stück Obst. Bei einer sogenannten galvanische Zelle bzw. einem galvanisches Element wird chemische in elektrische Energie umgewandelt. Ein fertiges Set für dieses Physik-Experiment können Sie zum Beispiel hier kaufen.
Was wird gebraucht?
- Obst oder Gemüse: z.B. Zitrone, Apfel, Kartoffel, Kiwi, Grapefruit usw.
- Zinkblech (Fläche ca. 3 bis 4 Quadratzentimeter), dicker Zinkdraht oder ein Zinknagel
- Kupferblech (Fläche ca. 3 bis 4 Quadratzentimeter), dicker Kupferdraht oder eine Kupfermünze (z.B. 1-, 2- oder 5-Cent-Münze)
- mindestens zwei Drähte mit Krokodilklemmen (oder auch ohne)
- Spannungsmesser/analoges Multimeter (bis ca. 1 Volt) oder eine Uhr bzw. ein Birnchen, das sich mit wenig Strom betreiben lässt. Auch Kopfhörer mit Klinkenanschluss sind für dieses Experiment geeignet. Man berührt die Spitze des Steckers mit einer Krokodilklemme bzw. einem Drahtende und mit dem anderen Ende die sogenannte Masse. Das ist der Bereich über dem Gummiring, wenn man Richtung Kabel blickt.
Was ist zu tun?
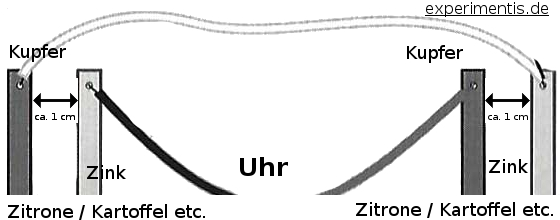
Strom mit einer Zitrone erzeugen? Kein Problem: Für diesen physikalischen Versuch rollt und presst man zunächst die Zitronen mit der Hand auf einer Tischplatte hin und her. Das Rollen und Pressen erleichtert die Wanderung der Ionen im Elektrolyten. Danach wird in jede Zitrone ein Kupfer- und ein Zinkelement gesteckt (siehe Fotos) und diese über die Drähte verbunden. Der Abstand zwischen den Elementen sollte etwa einen Zentimeter betragen. Sie dürfen sich aber nicht berühren.
Hat man keinen Draht mit Krokodilklemmen zur Hand, kann man auch einfachen Draht nehmen, an dessen Enden man jedoch die isolierende Schicht entfernen muss.
Dies macht man, indem man den Draht am Ende mit einer Schere und einer drehenden Bewegung bis zum Kupfer einschneidet und die isolierende Schicht dann abzieht. Die Enden des so präparierten Kabels klebt man mit Klebeband an das Zink- bzw. Kupferelement.
Danach kann man mit dem Spannungsmessgerät zwischen den beiden Blechen eine Spannung von ca. 0,5 Volt abgreifen und einen Strom von ca. 0,1 Milliampere messen. Verwendet man den Kopfhörer, dann hört man ein leichtes Knistern.
Für größere Spannungen versieht man mehrere Zitronen mit je einem Zink- und Kupferelement und verbindet diese (s. Fotos mit zwei Zitronen). Man hat dann eine Reihenschaltung, in der sich die einzelnen Spannungen addieren.
Was ist geschehen?
Eine Zitrone enthält wie auch andere Obst- und Gemüsesorten Ionen. Darunter versteht man Atome, die elektrisch geladen sind. Hat ein solches Atom zu viele Elektronen, ist es negativ geladen. Besitzt es zu wenig Elektronen, ist es positiv geladen.
Ionen sind immer bestrebt, entweder die ihnen fehlenden Elektronen aufzunehmen oder das, was sie an Elektronen zu viel haben, abzugeben.
- Das Zink ist bestrebt, Elektronen abzugeben, während die Ionen im Zitronensaft Elektronen aufnehmen.
- Am Kupferblech lagern sich positiv geladene Ionen aus dem Zitronensaft an. Sie nehmen Elektronen von den Kupferatomen auf.
Das Zink- bzw. Kupferelement werden die Elektroden genannt. Damit es zum Austausch von Elektronen kommt, braucht es also folgendes:
- einen Pluspol (das Kupfer), der Elektronen aufnimmt
- einen Minuspol (das Zink), der Elektronen abgibt
- einen Leiter (der Draht), durch die Elektronen vom Zink zum Kupfer wandern können
- und einen Elektrolyt (der Zitronensaft), in dem die Ionen gelöst sind.
Die Reaktion kommt zum Stillstand, wenn entweder keine Ionen mehr vorhanden sind bzw. deren Konzentration zu niedrig wird oder wenn die Bleche mit Fremdatomen überzogen sind.
Die ersten bekannten Experimente zur Umwandlung von chemischer in elektrische Energie machten die italienischen Physiker Luigi Galvani (1737-1798) und Alessandro Volta (1745-1827). Für das erste galvanische Element verwendete Volta 1794 ebenfalls Kupfer- und Zinkelektroden sowie eine verdünnte Säure als Elektrolyt.
Als weitere Obst- und Gemüsesorten eignen sich zum Beispiel auch: Äpfel, Gurken, Grapefruit, Orangen, Tomaten, aber auch Limonade oder einfach Salzwasser. Man kann das Experiment dadurch variieren, indem man verschieden Obst- und Gemüsesorten verwendet. So lässt sich herausfinden, welches Obst oder Gemüse den meisten „Saft“ liefert.
Achtung: Nach dem Experimentieren ist das Obst nicht mehr zum Verzehr geeignet.
Quelle: Die Idee zu diesem Experiment stammt von folgendem Produkt „Einfache Küchenexperimente mit der Zitronenbatterie und der Kartoffelbatterie„.